一针纳米疫苗让多种癌症在小鼠身上被抑制:80%暴露于黑色素瘤的小鼠在250天仍无肿瘤
研究团队在 Cell Reports Medicine 发表的新论文揭示,一种将免疫佐剂与黑色素瘤肽抗原封装在脂质纳米粒中的疫苗,未来可能阻断多种癌症在体内的扩散。 在一个黑色素瘤模型的实验中,暴露于癌细胞三周后的接种组中,80%的小鼠在250天内仍然无肿瘤。 相比之下,未接种或使用非纳米粒子配方的小鼠都发展了肿瘤,且没有一个存活超过35天。 阿图科莱说:『通过将这些纳米粒子设计成通过多路径激活来激活免疫系统,并与癌症特异性抗原结合,我们可以显著提高存活率,抑制肿瘤生长。』
In This Article:
多通道激活的免疫疫苗:将佐剂与黑色素瘤肽包裹在脂质纳米粒中
该疫苗通过将免疫佐剂和黑色素瘤肽抗原封装在脂质纳米粒中实现。 据论文描述,纳米粒子能够通过多路径激活免疫系统,并与癌症特异性抗原协同作用,以抑制肿瘤生长并显现显著的生存优势。 阿图科莱补充道:『通过工程化设计,这些纳米粒子可同时激活免疫系统的多条通路,并与癌症特异性抗原相结合,使肿瘤生长得到显著抑制。』

关键实验结果:80%疫苗组在250天内无瘤,且对照组多发肿瘤
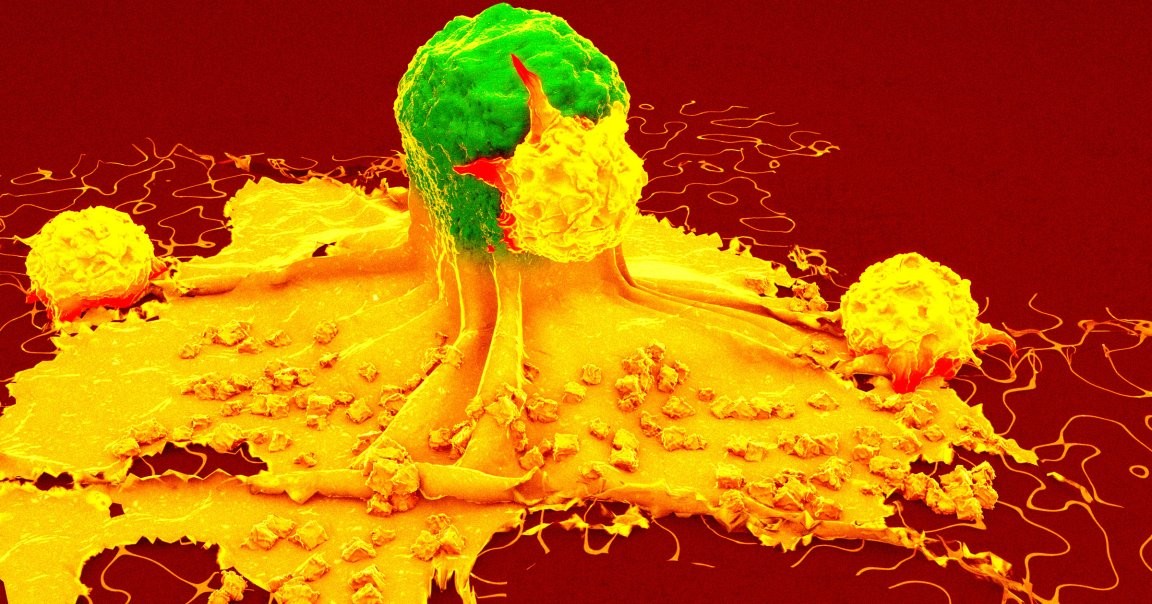
在另一组实验中,88%接种疫苗的小鼠暴露于胰腺癌后拒绝肿瘤; 另外,75%和69%分别在暴露于乳腺癌和黑色素瘤的情况下成功抵抗肿瘤。 在前述黑色素瘤实验中,80%接种组小鼠在250天内保持无瘤,与对照组形成鲜明对比。 疫苗通过激活T细胞,使其能够识别并攻击肿瘤细胞。

免疫机制与记忆免疫:肿瘤特异性T细胞与记忆如何推动生存收益
研究人员指出,『肿瘤特异性T细胞反应是生存收益背后的真正关键。』 第一作者格里芬·凯恩解释道:『我们所能产生的肿瘤特异性T细胞反应,是生存收益背后的核心。』 当用这类配方刺激先天免疫细胞时,会产生强烈的免疫激活,促使这些细胞呈递抗原并启动肿瘤杀伤性T细胞。 阿图科莱还指出:『转移是癌症面临的最大难题,绝大多数肿瘤死亡仍来自转移,这使得治疗黑色素瘤和胰腺癌等困难癌症更加棘手。』

前景与挑战:能否在人类身上复制,安全性仍在评估之中
该设计未来有望用于治疗和预防多种癌症,目前正在他们的新创公司 NanoVax Therapeutics 进行探索。 然而,将同样的方法应用于人体以证实效果与安全性,仍需多年研究;科学家们也在评估可能的风险。 未来研究将纳入额外的系统性炎症标志物和组织水平病理指标,以充分评估耐受性并支持临床转化。 记忆免疫的存在也意味着免疫记忆可在全身范围持续,这为免疫治疗带来希望,但安全性评估必须系统化完成。


