Tenía 25 Años, Estaba Muerto y Le Dijeron 'Lo Hemos Intentado Todo' Cómo David Fajgenbaum Persiguió Su Propia Cura y Expuso un Sistema Roto
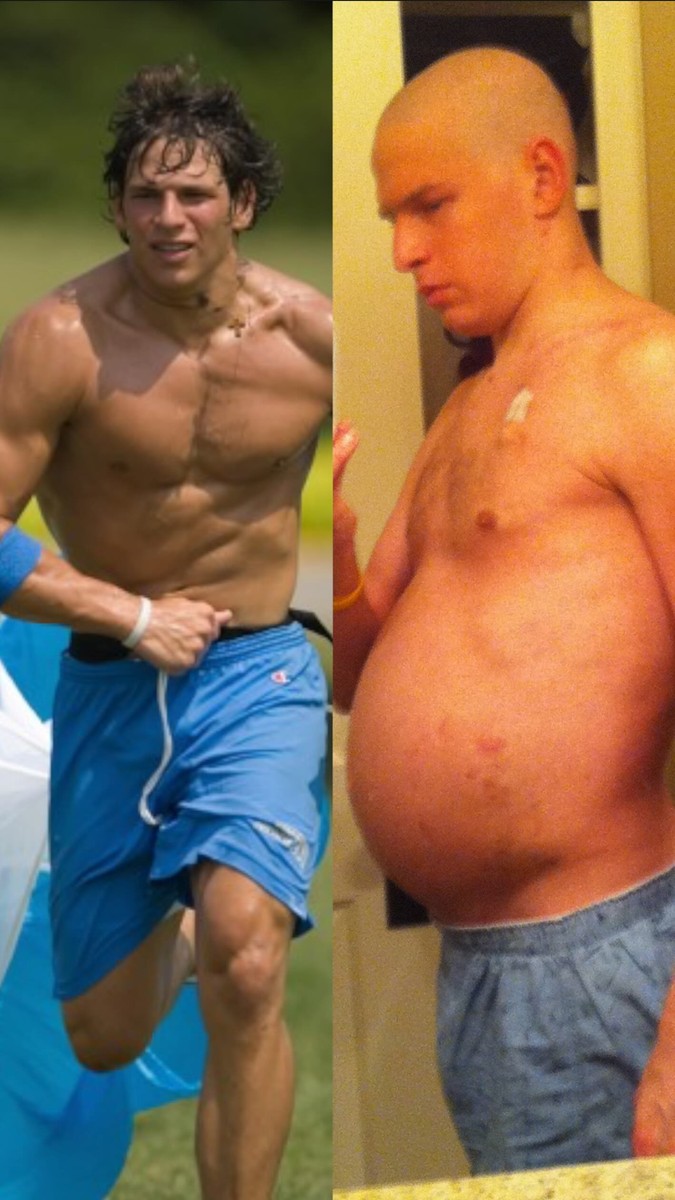
En 2010, con 25 años, David Fajgenbaum yace en una cama de hospital mientras su cuerpo se apaga. No metafóricamente. Literalmente—órgano por órgano. Los médicos entran en su habitación y le entregan la sentencia que termina la esperanza sin drama, sin consuelo, sin “David, we’ve tried everything. There’s nothing more we can do.” Al principio, apenas lo procesa. Lo entiende solo cuando su familia entra. Solo cuando empiezan a abrazarlo como si fuera la última vez. Y cuando un sacerdote llega para leerle los últimos ritos. Y la ironía corta más que la propia enfermedad: David no es un paciente cualquiera. Es un estudiante de medicina. Un ex quarterback de la universidad. Un joven que decidió convertirse en médico tras la muerte de su madre. Construyó su vida alrededor de la medicina—solo para terminar enfrentándose a una enfermedad de la que ni siquiera había oído hablar en la facultad: Castleman disease. Una rara y brutal alteración inflamatoria en la que el sistema inmunitario—a menudo por motivos que nadie puede explicar claramente—se vuelve contra el cuerpo y empieza a extinguir órganos vitales. Sin terapias aprobadas. Sin una ruta real. Sin cura. Solo colapso. En ese momento, el equipo médico intenta la última salida desesperada: una combinación de siete fármacos quimioterápicos—no porque estén diseñados para Castleman, sino porque no quedaba otra. Siete quimioterapias como un puñetazo a ciegas en la oscuridad. Y entonces ocurre algo cercano a un milagro. “Amazingly, they worked,” he says. Él sobrevive. Regresa a la escuela. Prosigue con su vida. Más tarde incluso hace lo que bromea podría ser “la peor foto de antes y después de todos los tiempos”—un recordatorio, para inspirar, pero en su caso prueba cuán brutal puede aplastar la enfermedad el cuerpo humano. La sala se ríe. Pero la historia de David no es una comedia. Porque luego la enfermedad regresa. Y otra vez. Y otra. Cinco veces en tres años, él “nearly dies” de la misma afección. Cinco veces. Tres años. Eso no es “una batalla.” Es un bucle de ejecuciones programadas que siguen posponiéndose. Durante la tercera recaída, la escena se vuelve casi insoportable: David está en la cama, su novia Caitlin a su lado, su familia cerca, y su bata de hospital está “empapada de lágrimas.” Ya no es solo por miedo a morir de nuevo; es porque puede ver—claramente, violentamente—lo que se le va a quitar si no sobrevive esta vez: la familia que no tendrá con Caitlin. Los pacientes que nunca tratará. Las curas que nunca descubrirá en memoria de su madre. Hasta ese punto, había esperado. Había confiado. En algún laboratorio alguien encontraría una terapia a tiempo. Pero llega la realización que cambia todo: “Hope alone isn’t enough.” Ese es el punto de inflexión. Si quiere una oportunidad, no puede quedarse ahí esperando a la ciencia. Tiene que ir tras ella. Tiene que convertirse de paciente que espera a paciente que caza. Pero hay un problema que rompe la idea romántica: desarrollar un fármaco desde cero toma el sistema “15 años y un mil millones de dólares.” No tiene 15 años. Tiene meses, quizá menos, y un cuerpo que falla. Así que se agarra a la única estrategia que puede moverse a la velocidad de una persona al borde de la muerte: si esos siete quimioterápicos lo salvaron—aunque ninguno fue diseñado para su enfermedad—entonces tal vez en algún lugar hay otro fármaco, desarrollado para otra enfermedad, que pueda reutilizarse para salvarlo. La reutilización de fármacos. No es un concepto nuevo. Él toma como ejemplo lo que casi todos conocen: Viagra. Originalmente desarrollado para problemas cardíacos, luego reutilizado para algo completamente distinto. Y después reutilizado de nuevo—usado hoy para una rara condición pulmonar pediátrica. Luego menciona la thalidomide: infame por provocar horribles defectos de nacimiento, posteriormente reutilizada para lepra y mieloma múltiple. ¿Por qué es posible la reutilización? Porque enfermedades que pueden verse distintas pueden compartir los mismos mecanismos biológicos subyacentes. Si la misma vía está rota en dos enfermedades distintas, el mismo fármaco puede cerrarla o corregirla en ambas. Y entonces señala un hecho que la mayoría de personas no médicas no saben, pero que una vez que lo escuchas cambia toda la conversación: los médicos pueden recetar cualquier fármaco aprobado por la FDA para cualquier enfermedad si creen que el beneficio potencial supera el riesgo. Eso se llama uso fuera de etiqueta (off-label). No es una solución marginal. Él dice: “one in four prescriptions” in the United States is off-label. One in four. Every day. Entonces lleva la idea a sus límites: empieza a estudiar su sangre en un laboratorio, tratando de identificar un fármaco ya existente—algo que pueda calmar el caos inmune que le está matando. Descubre que una línea de comunicación en su sistema inmunitario está amplificada mucho más allá de lo normal. Y encuentra que un viejo fármaco para trasplantes—usado durante décadas—podría ser capaz de apagar esa línea. Ese fármaco nunca se ha usado para Castleman disease. Pero no tiene opciones. Y entonces dice la frase que suena a coraje científico y desesperación cruda a la vez: “I started testing it on myself.” Sirolimus. En los tres años previos al sirolimus, él casi muere cinco veces. Después de empezar, ha estado en remisión por más de 11 años. Once. La sala aplaude. La gente vitorea. Por un momento, parece el final de la historia. Pero David no la vende como un milagro personal. La convierte en una acusación contra el sistema. Durante esos años en remisión, él se casa con Caitlin. Tienen dos hijos. Escribe un libro, Chasing My Cure, que dice que está siendo adaptado a una película. Se convierte en profesor en la Universidad de Pennsylvania. Y en lugar de decir “I’m saved,” plantea la pregunta más oscura: What about everyone who doesn’t have the chance—or the knowledge—or the stubbornness—to do what he did? ¿Y qué pasa con todos los que mueren mientras la solución está ante nosotros? En 2022, cofundó una organización llamada Every Cure. Su misión es brutal en su simplicidad: desbloquear “el potencial completo de cada fármaco” para “todas las enfermedades” que puede tratar. Afirma que ya han avanzado 14 tratamientos reutilizados para múltiples enfermedades, salvando miles de vidas. Pero no se queda ahí. Nombra a personas. Kylo, que gracias a un fármaco reutilizado para cáncer de médula ósea pudo empezar su primer año de escuela de enfermería. Ese tratamiento ya se estudia en ensayos clínicos. Michael, que llevó a su hijo al pasillo en su boda tras que un fármaco contra melanoma se reutilizó para tratar el cáncer raro de Michael. Ese enfoque, dice, ya se usa en todo el mundo para ese cáncer raro. Y luego expone su argumento central como un golpe duro: ¿cuántos usos de fármacos existentes que salvan vidas están reposando en estantes de farmacias sin utilizarse, no por falta de ciencia sino por falta de incentivos? “La humanidad ha desarrollado alrededor de 4.000 fármacos para alrededor de 4.000 enfermedades. Pero hay más de 14.000 enfermedades sin terapia aprobada.” Uno de cada diez de nosotros y de nuestros hijos desarrollará una enfermedad rara sin terapia aprobada. La respuesta corta es que simplemente no es rentable buscar un nuevo uso para un fármaco ya existente, especialmente para una enfermedad rara. Nadie, ni el NIH, ni la FDA, ni la industria farmacéutica, nadie ha asumido la responsabilidad… hasta ahora, añade—marcando a su organización como un intento de llenar ese vacío. Aquí es donde presenta la herramienta que va a usar: la inteligencia artificial. Every Cure usa IA para “scan across the world’s knowledge” de los 4.000 fármacos y las 18.000 enfermedades, para encontrar las coincidencias más prometedoras. Explica con una comparación que todos entienden: Netflix. Del mismo modo que Netflix usa datos sobre actores, directores y lo que has visto para predecir lo que verás a continuación, su IA usa conocimiento sobre fármacos y enfermedades—y cómo se relacionan—para predecir qué fármaco aprobado podría funcionar para una enfermedad para la que no fue diseñado. No es magia de IA vaga, insiste. Es un problema de filtrado masivo.La IA evalúa “millones de coincidencias fármaco–enfermedad,” las clasifica por impacto potencial y después impulsan esos programas: laboratorios, ensayos clínicos, o—cuando ya existe evidencia—llevar la terapia a la luz para que los médicos la usen. Al principio, él admite, incluso ellos no sabían cómo harían esto real. O lo financiarían. Recibe un correo de la comunidad TED sobre The Audacious Project—una iniciativa que selecciona alrededor de diez organizaciones sin fines de lucro al año para financiar soluciones audaces a problemas gigantes. El simple hecho de saber que existía les dio el valor para dar el salto. Fundaron la organización. Presentaron la solicitud. Estuvieron “tan esperanzados” de ser seleccionados. No lo fueron. La sala se ríe porque lo cuenta como un momento de vida, no como un fracaso de relaciones públicas. Así que lo volvieron a intentar. Y “hace apenas unos meses” recibieron una financiación transformadora. Otro apoyo, dice, llegó de la agencia federal ARPA-H. Con eso, afirma que están construyendo una motor de IA destinado a reutilizar de 15 a 25 tratamientos para 2030—y con más fondos, “docenas, incluso cientos.” Luego regresa a donde empezó todo: la enfermedad de Castleman. Otro paciente. No David. Mismo diagnóstico aterrador. Los tratamientos que David encontró para sí mismo no funcionaron para este paciente. Él estaba a punto de decir adiós a su esposa e hija. Estaba a punto de ser trasladado a cuidados paliativos. Every Cure recomendó el “número uno fármaco” de su plataforma. “Y, sorprendentemente, salvó su vida,” dice David. Ese paciente ha estado en remisión por más de dos años. Pero a veces, David explica, no se trata de descubrir una coincidencia nueva: a veces la coincidencia ya existe—enterrada en papeles, conocida por unos pocos especialistas, nunca adoptada de forma general. Ahí comparte una de las secuencias más impactantes de su charla: Leucovorin—un compuesto barato derivado de vitaminas—tiene evidencia que sugiere que puede mejorar el habla en un subgrupo de niños que tienen anticuerpos contra el receptor de folato y no pueden transportar el folato al cerebro. Señala al investigador Richard Frye, que dirigió el primero de tres ensayos controlados aleatorizados que mostraron beneficio en ese subgrupo. Y nombra a un niño: Mason. Tres años. No verbal. Y luego—según David: “Within three days of starting leucovorin, he began saying his first words.” Aplausos. Luego otro niño: Ryan. Cinco años. “Prácticamente no verbal.” Nunca compartió un pensamiento o sentimiento completo con sus padres. Los doctores le dijeron que probablemente nunca podría expresar emoción. Y luego, “within two weeks” de leucovorin, Ryan se vuelve hacia su padre antes de ir a trabajar y dice: “Daddy, I love you.” La sala estalla. David no lo usa como clímax sentimental. Lo usa como otra acusación: existe una prueba de sangre que puede identificar a niños como Mason y Ryan—y esa prueba, dice, todavía se usa poco. Por eso construyeron Every Cure: para desbloquear tratamientos ocultos y asegurarse de que lleguen a cada paciente que podría beneficiarse. Añade otra historia desde el borde de la medicina: Joseph, que muere de POEMS, un cáncer raro. En su 30.º cumpleaños, le decía adiós a su novia Tara. Su médico ya lo había probado todo. Every Cure recomendó tres fármacos “comúnmente usados para mieloma” porque POEMS es similar. “Y sorprendentemente—funcionaron,” dice David. En lugar de planear el funeral de Joseph, Joseph y Tara están planificando su boda. Y Joseph está en la audiencia. A estas alturas, su tesis se ha vuelto humana y brutal: esto no se trata de “optimizar la investigación.” Se trata de personas que están diciendo adiós—y luego, de alguna manera, no mueren. Y de un sistema que permite que eso ocurra por casualidad en lugar de práctica estándar. Hacia el final, eleva la mirada desde historias individuales y va directo a la frase que atormenta a cualquiera que haya estado al lado de una camilla de hospital: ¿Cuántos de nosotros hemos estado con alguien a quien amamos y hemos oído, “We’ve tried everything. There’s nothing more we can do”? Y entonces hace la pregunta que derrumba la confianza de ese final médico: “What if we haven’t tried everything?” ¿Y si la solución existe para ellos—y para miles, quizá millones, con la misma enfermedad? En la discusión después de la charla, el presentador Latif Nasser dice lo que todos están pensando: suena “too good to be true.” La gente muere esperando una cura, pero quizá la respuesta sea algo tan simple—y tan increíble—como ir a la farmacia de la esquina y encontrar un fármaco que podría ayudar. David responde sin dudar: “That’s right.” Y luego repite la razón: “…except it simply isn’t profitable to do this.” Nasser lo contextualiza en la historia de la medicina: antes la medicina era de “curas milagrosas,” luego se hizo basada en evidencia, enfocada, láser. ¿Está diciendo David que necesitamos ensanchar la mirada de nuevo? “Exactly,” dice David. Añade algo que suena a una confesión quieta sobre cómo funciona la industria: a las empresas a menudo les interesa considerar 15, 20, incluso 30 enfermedades para un solo fármaco, pero deben elegir una o dos—mientras las otras posibilidades “se pierden.” Su organización existe para sacar esas posibilidades perdidas de las rendijas. Y cuando se pregunta qué puede hacer un ciudadano común, él se mantiene práctico: si alguna vez te has beneficiado de un fármaco fuera de etiqueta o reutilizado, cuéntalo. Los ensayos cuestan dinero. La conciencia y las donaciones ayudan a avanzar el trabajo. Pero la línea más contundente en su cierre no es un pitch de recaudación de fondos: es un estándar moral para una civilización que tiene 4.000 fármacos y 18.000 enfermedades: No debería haber paciente que sufra cuando un fármaco que salva vidas está “sitting on a shelf in a pharmacy.” Y nadie debería verse obligado a aceptar “we’ve tried everything” como el final—cuando “everything” podría estar esperando, aún sin abrir, justo delante de nosotros.
In This Article:
- Diagnóstico sin esperanza y la sentencia que desencadena todo
- La esperanza no basta: convertir al paciente en cazador y el giro hacia la reutilización de fármacos
- Every Cure y la promesa de la inteligencia artificial para liberar fármacos
- Historias que demuestran que el sistema falla y el costo humano
- ¿Qué podemos hacer como personas comunes? Un imperativo moral
Diagnóstico sin esperanza y la sentencia que desencadena todo
La noticia de la enfermedad llega cuando la vida de David parece terminar. Castleman disease, una rara y brutal alteración inflamatoria, pone en riesgo órganos vitales y no hay terapias aprobadas ni una ruta clara. El equipo médico recurre a siete quimioterapias, usadas como último recurso, no para Castleman sino porque no queda otra cosa. "Amazingly, they worked," dice David. Tras sobrevivir, regresa a la escuela y su vida continúa, pero la enfermedad regresa cinco veces en tres años. En la tercera recaída, la escena se vuelve insoportable: el miedo a perder a su familia y a no poder lograr lo que su madre no pudo lograr. “Hope alone isn’t enough.” A partir de ahí debe buscar su cura, no esperarla. image_url_2

La esperanza no basta: convertir al paciente en cazador y el giro hacia la reutilización de fármacos
La idea de que la esperanza por sí sola no es suficiente empuja a David a pasar de paciente que espera a cazador de curas. Señala que desarrollar un fármaco nuevo puede tomar 15 años y mil millones de dólares, así que mira a la reutilización de fármacos: si los siete fármacos que lo salvaron no estaban hechos para Castleman, quizá otro fármaco aprobado para otra enfermedad puede salvarlo. Explica que los médicos pueden recetar cualquier fármaco aprobado por la FDA si el beneficio supera el riesgo (uso fuera de etiqueta): “one in four prescriptions” in the United States is off-label. Comienza a estudiar su sangre en el laboratorio para identificar un fármaco ya existente, y descubre que una línea de comunicación en su sistema inmune puede estar amplificada. “I started testing it on myself.” El Sirolimus lo salva y lo lleva a más de 11 años de remisión. También escribe Chasing My Cure, se convierte en profesor en UPenn y funda Every Cure. image_3

Every Cure y la promesa de la inteligencia artificial para liberar fármacos
En 2022, Fajgenbaum cofundó Every Cure para desbloquear el potencial de fármacos existentes para enfermedades sin tratamiento. La misión: aprovechar el 4,000 de fármacos para 4,000 enfermedades, y las más de 14,000 enfermedades sin terapias aprobadas. Con IA analiza millones de coincidencias fármaco–enfermedad y prioriza las más prometedoras para avanzar a laboratorios, ensayos o uso clínico. Habla de The Audacious Project de TED, ARPA-H y el objetivo de reutilizar 15–25 tratamientos para 2030; con más fondos, “dozens, even hundreds.” El caso delCastleman y otro paciente demuestran que a veces la coincidencia ya existe, solo hay que verla. También describe leucovorin, que ha mostrado beneficios en subgrupos de pacientes, como Mason y Ryan, cuyas palabras salieron a la luz tras empezar el tratamiento: “Within three days of starting leucovorin, he began saying his first words.” Joseph, con POEMS, es otro ejemplo: tres fármacos que se usan para mieloma funcionan en su caso. El mensaje final es claro: no hay que conformarse con “we’ve tried everything.” image

Historias que demuestran que el sistema falla y el costo humano
Kylo, un caso de banco de sangre, o Mason y Ryan con leucovorin; Joseph con POEMS; son ejemplos de pacientes a quienes se les podría haber salvado con fármacos ya existentes. Leucovorin mostró resultados como Mason hablando a los tres días de empezar y Ryan diciendo “Daddy, I love you” a las dos semanas. Pero la prueba de sangre para identificar a estos niños debe usarse más y el sistema debe cambiar para que estas terapias lleguen a tiempo. Joseph, de 30 años, celebró su boda tras responder a tres fármacos comunes para mieloma usados con éxito para POEMS. No es un caso aislado: la ciencia existe, la financiación a menudo no. image

¿Qué podemos hacer como personas comunes? Un imperativo moral
En la discusión final, Latif Nasser pregunta si es ingenuo pensar que la solución podría estar en la farmacia de la esquina. David responde: “That’s right” y añade que la razón es simple: no es rentable. Nasser ubica la historia en la trayectoria de la medicina, de curas milagrosas a medicina basada en evidencia, y David acepta la necesidad de ampliar el foco. Explica que las compañías suelen estudiar 15, 20 o 30 enfermedades por un solo fármaco y luego eligen una, dejando las demás en las sombras. Su organización busca sacar esas posibilidades perdidas de las rendijas. Si alguien se ha beneficiado de un uso fuera de etiqueta, que lo cuente. Los ensayos cuestan dinero; la conciencia y las donaciones impulsan el trabajo. Pero la línea más contundente es un estándar moral: nadie debería sufrir cuando un fármaco salvador está “sitting on a shelf in a pharmacy.” Y nadie debería verse obligado a aceptar que “we’ve tried everything” es el final— cuando “everything” podría estar esperando, sin abrir, justo delante de nosotros.


