Miałem 25 lat, umierałem, a powiedziano mi, że próbowano wszystkiego — David Fajgenbaum otwiera własną drogę do leku i obnaża zepsuty system
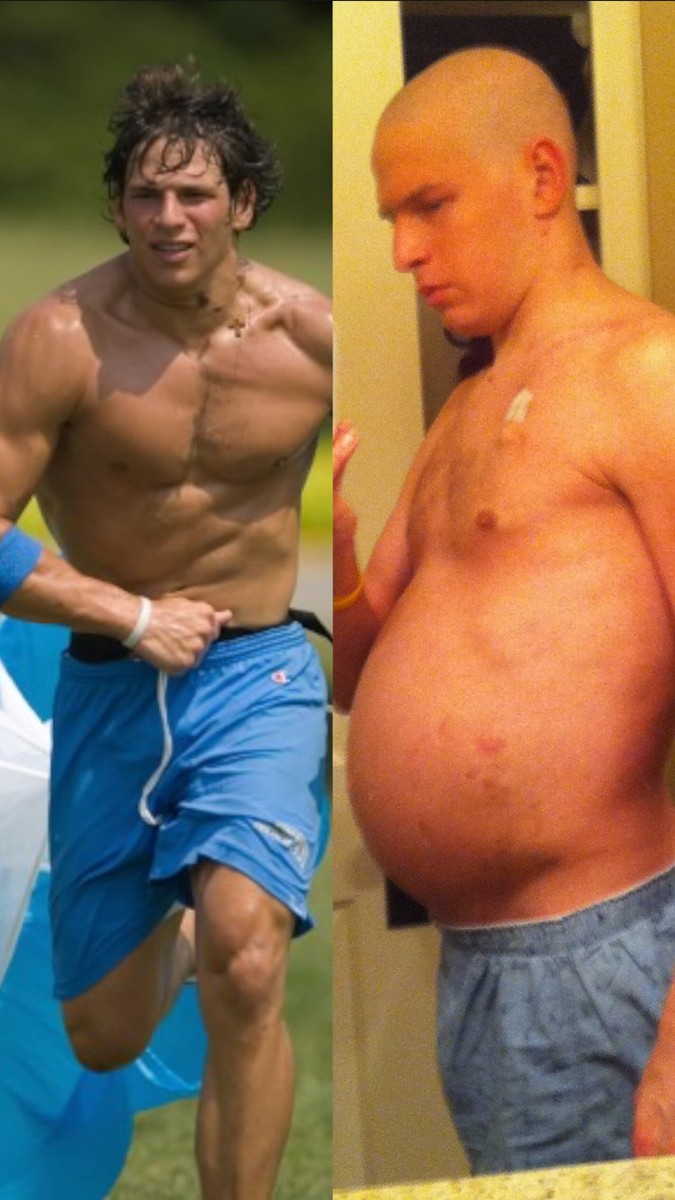
W 2010 roku, mając 25 lat, David Fajgenbaum leży w łóżku szpitalnym i obserwuje, jak jego ciało dosłownie przestaje działać — organ po organie. Lekarze wchodzą do jego pokoju i mówią zdanie, które kończy nadzieję bez dramaturgii, bez pocieszenia, bez „spróbujmy jeszcze jednej rzeczy”: „David, próbowaliśmy wszystkiego. Nie ma nic więcej, co możemy zrobić.” Na początku prawie to przetwarza. Rozumie, co to znaczy, dopiero gdy wchodzą jego rodzina. Dopiero gdy zaczynają go tulić tak, jak ludzie tulą cię, gdy myślą, że to ostatni raz. Dopiero gdy kapłan przychodzi, by odczytać mu ostatnie namaszczenie. I ironia przebija się głębiej niż sama choroba: David nie jest tylko pacjentem. Jest studentem medycyny. Byłym quarterbackiem college’u. Młodym człowiekiem, który zdecydował zostać lekarzem po tym, jak jego matka zmarła na raka. Zbudował swoje życie wokół medycyny — tylko po to, by umrzeć na chorobę, o której przyznaje, że nigdy nie słyszał w medycznej school: chorobę Castlemana. To rzadkie, brutalne zapalne zaburzenie, w którym układ odpornościowy—często z powodów, które nikt nie potrafi jasno wyjaśnić—zaczyna atakować ciało i zaczyna gasić kluczowe narządy. Brak zatwierdzonych terapii. Brak realnego planu działania. Brak lekarstwa. Tylko upadek. W tym momencie zespół medyczny sięga po ostatni desperacki ruch: połączenie siedmiu leków chemioterapeutycznych—not because they are designed for Castleman disease, but because there’s nothing else left. Siedem chemioterapii jako ślepy cios w ciemność. I wtedy dzieje się coś, co zbliża się do cudu. „Niesamowicie, zadziałały,” mówi. Przetrwał. Wraca do szkoły. Kontynuuje swoje życie. Później nawet robi to, co żartobliwie nazywa „najgorsze zdjęcie przed‑i‑po w całej historii”—zdjęcie mające inspirować, ale w jego przypadku dowód na to, jak brutalnie choroba potrafi zgniatać ciało. Sala śmieje się. Ale historia Davida nie jest komedią. Bo choroba wraca. I znów. I znów. Pięć razy w trzy latach, gdy ten sam potworny cykl powraca: „prawie umiera” z tej samej choroby. Pięć razy. Trzy lata. To nie jest „bitwa”. To pętla wyroków, które wciąż się odracza. Podczas trzeciego nawrotu scena staje się niemal nie do zniesienia: David leży w łóżku, jego dziewczyna Caitlin u boku, rodzina blisko, a jego hospital gown jest „namoczony łzami.” Nie płacze tylko dlatego, że umiera ponownie. Płacze, bo widzi — jasno, gwałtownie — co zostanie mu odebrane, jeśli nie przeżyje tej próby: rodzinę, którą Caitlin i on mogliby mieć. Pacjentów, których nigdy nie będzie leczyć. Leków, których nigdy nie odkryje w pamięci matki. Do tego momentu czekał. Miał nadzieję. Gdzieś, ktoś w laboratorium znajdzie terapię na czas. Ale wtedy dostrzega to, co zmienia wszystko: „Nadzieja sama w sobie nie wystarcza.” To punkt zwrotny. Jeśli chce mieć szansę, nie może po prostu leżeć i modlić się o nadejście nauki. Musi po nią iść sam. Musi przestać być pacjentem, który czeka, a stać się pacjentem, który poluje. Jednak istnieje jeden problem, który niszczy romantyczną wersję tej idei: opracowanie nowego leku od zera wymaga systemowi „15 lat i miliarda dolarów.” Nie ma 15 lat. Ma miesiące, a ciało mu się wyczerpuje. Dlatego wybrał jedyną strategię, która może iść w tempie człowieka umierającego: jeśli te siedem chemioterapii uratowały go — chociaż żaden nie był stworzony dla jego choroby — to może gdzieś dalej jest inny lek, zaprojektowany dla innej choroby, który można ponownie zastosować, by go ocalić. Przypisanie leków do nowych zastosowań nie jest nową koncepcją. Sięga po przykład, który prawie każdy zna: Viagra. Oryginalnie opracowana dla problemów sercowych, potem ponownie zastosowana do czegoś zupełnie innego. A później ponownie — używana dziś w rzadkim pediatrycznym schorzeniu płuc. Potem wspomina thalidomide: znany z przerażających wad wrodzonych, później ponownie zastosowany przy trądzie i szpiczaku mnogim. Dlaczego ponowne zastosowanie w ogóle jest możliwe? Ponieważ choroby, które wyglądają inaczej, mogą mieć wspólne mechanizmy biologiczne. Jeśli ta sama ścieżka jest zaburzona w dwóch różnych schorzeniach, ten sam lek może ją wyłączyć — lub skorygować — w obu. I potem pada fakt, którego większość ludzi nie wie, ale kiedy go słyszysz, przeobraża cały dialog: Lekarze mogą przepisać dowolny zatwierdzony lek FDA na dowolną chorobę, jeśli wierzą, że potencjalne korzyści przeważają ryzyko. To nazywa się przepisywaniem poza wskazaniem. To nie jest marginesowy obejście. On mówi: „jedno na cztery recepty” w Stanach Zjednoczonych jest przepisywane poza wskazaniem. Jedno na cztery. Każdego dnia. Dlatego podejmuje najbardziej ekstremalną wersję tego, o czym mówi. Zaczyna badać własną krew w laboratorium, próbując zidentyfikować lek, który już istnieje—coś, co może uspokoić immunologiczną burzę zabijającą go. Odkrywa, że jeden „kanał komunikacyjny” w jego układzie odpornościowym jest wyostrzony daleko poza normalny. I stwierdza, że staro transplantacyjny lek—używany od dekad—może ten kanał wyciszyć. Ten lek nigdy nie był używany dla choroby Castlemana. Ale nie ma opcji. I wtedy wypowiada zdanie, które brzmi jak odwaga naukowa i surowa desperacja jednocześnie: „Zacząłem to testować na sobie.” Sirolimus. W trzy latach poprzedzających sirolimus, prawie umarł pięć razy. Po jego rozpoczęciu, pozostaje w remisji przez ponad jedenaście lat. Jedenaście. Sala aplauzuje. Ludzie wiwatują. Przez chwilę wydaje się, że to koniec historii. Ale David nie przedstawia tego jako osobistego cudu. Zmienia to w oskarżenie systemu. W czasie remisji poślubia Caitlin. Mają dwójkę dzieci. Pisze książkę, *Ścigając moje lekarstwo*, która, jak mówi, ma być zekranizowana. Staje się profesorem na Uniwersytecie Pensylwiańskim. A zamiast mówić „Jestem uratowany,” stawia pytanie: Co z ludźmi, którzy nie mają szans — lub wiedzy — lub uporu, by zrobić to, co on zrobił? Co z tymi, którzy giną, gdy rozwiązanie jest na wyciągnięcie ręki? W 2022 roku współzałożył organizację Every Cure. Jej misja jest brutalnie prosta: odblokować „pełny potencjał każdego leku” dla „każdej choroby”, którą może leczyć. Twierdzi, że już opracowali 14 ponownie zastosowanych terapii dla wielu chorób, ratując tysiące ludzi. Ale nie ogranicza się do liczb. Wymienia ludzi. Oto Kylo — która, dzięki ponownie zastosowanemu lekowi na raka szpiku, mogła rozpocząć pierwszy rok nauki w zawodzie pielęgniarki. Ta terapia jest teraz badana w badaniach klinicznych. Jest Michael, który odprowadził swojego syna do alejki w dniu ślubu po tym, jak lek na czerniaka został ponownie zastosowany w leczeniu rzadkiego nowotworu Michaela. Ten sposób leczenia — jak mówi — jest teraz używany na całym świecie dla tego rzadkiego nowotworu. A potem przedstawia swoją tezę jak ciężkie narzędzie: Ile istniejących leków ratujących życie zalega na półkach aptek—nieużywanych—nie dlatego, że nauka ich nie potrafi, lecz dlatego, że system nie ma zachęty, by je szukać? Przedstawia to liczbami, które brzmią niemal obscenicznie: Człowiek opracował około 4 000 leków dla około 4 000 chorób. Ale jest ponad 14 000 chorób bez zatwierdzonej terapii. Więcej niż 14 000. To nie jest nisza. To medyczny wszechświat pozostawiony pusty. Następnie dodaje: „Jedno na dziesięć nas i naszych dzieci rozwinie rzadką chorobę bez zatwierdzonej terapii.” Jedno na dziesięć. W jego oczach to skandal: Wiele istniejących leków mogłoby leczyć o wiele więcej chorób — za mniej niż jeden procent kosztów opracowania nowego leku, i znacznie szybciej. Dlaczego więc to nie dzieje się systemowo? Nie udaje mu się zafałszować prostą odpowiedź: to kwestia zysku. „Krótka odpowiedź jest taka: po prostu nie opłaca się szukać nowego zastosowania istniejącego leku, zwłaszcza dla rzadkiej choroby.” I dla „80% leków, które są już generykami,” badania kliniczne są kosztowne i firmy nie mogą realnie odzyskać kosztów poprzez sprzedaż. Więc system — jak zwykle — skupia się na nowych lekach dla chorób, które przynoszą zysk. I nie zwalnia nikogo z odpowiedzialności: „Nikt — ani NIH, ani FDA, ani przemysł farmaceutyczny — nikt nie wziął odpowiedzialności” za systemowe odblokowywanie tych ukrytych leków. „…aż do teraz,” dodaje — zaznaczając, że jego organizacja powstała, by wypełnić tę lukę. Tu wprowadza broń, na którą postawili: sztuczną inteligencję. Every Cure używa AI, aby „skanować wiedzę całego świata” o wszystkich 4 000 leków i 18 000 chorób, by znaleźć najobiecniejsze dopasowania. Wyjaśnia to porównaniem, które wszyscy rozumieją: Netflix. Tak jak Netflix wykorzystuje dane o aktorach, reżyserach i tym, co oglądasz, by przewidzieć, co będziesz oglądać, ich AI używa wiedzy o lekach i chorobach — i o tym, jak one ze sobą współgrają — by przewidzieć, który zatwierdzony lek mógłby zadziałać na chorobę, której nigdy wcześniej nie leczył. Nie chodzi o jakąś mgławicową magię sztucznej inteligencji. To poważny problem filtrowania. AI ocenia „miliony dopasowań lek–choroba,” klasyfikuje te z największym potencjałem wpływu, a następnie pcha te programy naprzód: laboratoria, badania kliniczne, albo — gdy dowody już istnieją — przenosi terapię do praktyki, by lekarze ją stosowali. Na początku, przyznaje, nawet oni nie wiedzieli, jak to zrealizować. Albo sfinansować. Koszty badań klinicznych są duże. Potem otrzymuje mail od społeczności TED o The Audacious Project — inicjatywie, która wybiera około dziesięciu organizacji non‑profit rocznie, by finansować odważne rozwiązania ogromnych problemów. Sam fakt istnienia projektu dodał im odwagi, by skoczyć. Założyli organizację. Zgłosili wniosek. Byli „tak bardzo nadziei,” że zostaną wybrani. Nie zostali. Sala śmieje się, bo opowiada to jak moment życiowy, a nie porażka PR. Więc założyli ponownie. I „zaledwie kilka miesięcy temu” otrzymali „transformacyjne finansowanie.” Dodatkowe wsparcie przyszło od amerykańskiej agencji ARPA‑H. Dzięki temu twierdzą, że budują silnik AI przeznaczony do ponownego wykorzystania 15–25 terapii do 2030 roku — a przy większym finansowaniu, „dziesiątki, a nawet setki.” Potem wraca do miejsca, gdzie wszystko się zaczęło: choroba Castlemana. Kolejny pacjent. Nie David. Ten sam koszmar diagnozy. Terapie, które David znalazł dla siebie, nie zadziałały dla tego pacjenta. On miał być przygotowany do pożegnania z żoną i córką. Miał być przeniesiony do hospicjum. Every Cure poleciło „numer jeden lek” z ich platformy. „I niesamowicie — uratował jego życie,” mówi David. Ten pacjent pozostaje w remisji od ponad dwóch lat. Ale czasami, David wyjaśnia, nie chodzi o odkrycie zupełnie nowego dopasowania. Czasem dopasowanie już istnieje — ukryte w papierach, znane garstce specjalistów, nigdy nie zastosowane szeroko. To właśnie tutaj znajduje się jedna z najbardziej szokujących sekwencji w jego przemówieniu: leucoworin — tani związek pochodzenia witaminowego — ma dowody sugerujące, że może poprawić mowę w podgrupie dzieci, które mają przeciwciała przeciwko receptorowi folianowemu i nie potrafią transportować folianu do mózgu. Wskazuje na badacza Richarda Frye’a, który przeprowadził pierwsze z trzech losowo‑kontrolowanych badań wykazujących korzyść w tej podgrupie. Następnie wymienia dziecko: Mason. Trzy lata. Niemy. A potem — według Davida: „W ciągu trzech dni od rozpoczęcia leucowowiryny, zaczął mówić pierwsze słowa.” Owacje. Następnie kolejne dziecko: Ryan. Pięć lat. „Prawie niemy.” Nigdy nie mówił pełnymi zdaniami ani nie okazywał emocji przed rodzicami. Lekarze powiedzieli im, że prawdopodobnie „nigdy nie będą w stanie wyrazić emocji.” A potem, „w ciągu dwóch tygodni” od leucowowiryny, Ryan patrzy na swojego ojca i mówi: „Tatusiu, kocham cię.” Sala wybucha. David nie wykorzystuje tego jako kulminacyjnego momentu sentymentalnego. Używa tego jako kolejnego oskarżenia: istnieje test krwi, który może identyfikować dzieci takie jak Mason i Ryan — i ten test, jak mówi, wciąż jest rzadko stosowany. Dlatego stworzyli Every Cure: aby odblokować ukryte terapie i upewnić się, że dotrą one do każdego pacjenta, który mógłby z nich skorzystać. Dodaje kolejną historię z granicy medycyny: Joseph, umierający na POEMS — zespół POEMS, rzadki nowotwór. W jego 30. urodziny żegnał się z dziewczyną Taryą. Jego lekarz już próbował wszystkiego, co przychodziło mu do głowy. Every Cure poleciło trzy leki „powszechnie używane” w leczeniu szpiczaka mnogiego, ponieważ POEMS jest podobny. „I niesamowicie — one zadziałały,” mówi David. Zamiast planować pogrzeb Józefa, Józef i Tara planują ich ślub. I Józef jest tam wśród widowni. Do tej pory jego teza stała się ludzką i brutalną: To nie o „optymalizację badań.” To o ludziach, którzy żegnają się — i potem, jakoś, nie umierają. I o systemie, który na to pozwala, aby to stało się przypadkiem, a nie standardową praktyką. W miarę zbliżania się do końca, podnosi wzrok od indywidualnych historii i przechodzi do zdania, które nawiedza każdego, kto kiedykolwiek był przy łóżku chorego: Ilu z nas było z kimś, kogo kochamy i słyszeliśmy, „Próbowaliśmy wszystkiego. Nie ma nic więcej, co możemy zrobić.” A następnie zadaje pytanie, które podważa pewność tego medycznego finału: „Co jeśli nie próbowaliśmy wszystkiego?” Co jeśli rozwiązanie istnieje dla nich — i dla tysięcy, być może milionów, z tą samą chorobą? Co jeśli lek już istnieje — i leży na półce w aptece? W dyskusji po wystąpieniu prowadzący Latif Nasser mówi, co wszyscy myślą: to brzmi „zbyt dobre, by było prawdziwe.” Ludzie umierają, czekając na odkrycie leku, ale może odpowiedź jest tak prosta — i tak kontrowersyjna — jak pójście do najbliższej apteki i znalezienie leku, który mógłby pomóc. David odpowiada bez wahania: „Masz rację.” A potem powtarza powód, dla którego to nie dzieje się: „…poza tym po prostu nie opłaca się to robić.” Nasser stawia to w kontekście historycznym: medycyna kiedyś była pełna „cure‑alls”, potem nowoczesna medycyna stała się dowodowa, ukierunkowana, laserowo precyzyjna. Czy David mówi, że trzeba ponownie poszerzyć perspektywę? „Dokładnie,” mówi David. Dodaje coś, co brzmi jak ciche wyznanie dotyczące działania branży: firmy często rozważają 15, 20, nawet 30 chorób dla jednego leku, ale muszą wybrać jedną lub dwie, na których skupić uwagę — a inne możliwości „wpadają w zapomnienie.” Jego organizacja istnieje, aby wyciągać te zapomniane możliwości z kruszących się szczelin. A gdy pytano, co może zrobić zwykły człowiek, pozostaje praktyczny: jeśli kiedykolwiek skorzystałeś z leku „off‑label” lub ponownie zastosowanego, opowiedz o tym. Badania kosztują pieniądze. Świadomość i darowizny pomagają przenieść pracę naprzód. Ale najgłębsza myśl w jego zakończeniu nie służy zbiórce pieniędzy. To moralny standard dla cywilizacji, która ma 4 000 leków i 18 000 chorób: żaden pacjent nie powinien cierpieć, gdy lek ratujący życie „stoi na półce w aptece.” I nikt nie powinien być zmuszony do akceptowania „próbowaliśmy wszystkiego” jako końca — gdy „wszystko” może nadal czekać, nieotwarte, prosto przed nami.
In This Article:
Nadzieja nie wystarcza. David postanawia sam szukać własnego leku
To moment, w którym David rozumie, że sama nadzieja nie wystarczy. Chce działać, nie czekać na to, aż nauka wyrośnie dla niego terapię. „Próbuje to i tamto” nie jest odpowiedzią, bo rozwój nowego leku od zera to „15 lat i miliard dolarów” — a on nie ma tyle czasu. Były quarterback uniwersytecki przegląda świat leków w poszukiwaniu możliwości ponownego zastosowania. Jeśli siedem chemioterapii uratowało go, to może istnieje inny lek, przeznaczony na inną chorobę, który można dopasować do jego przypadku. Lekarz mógłby przepisać lek FDA‑zatwierdzony na inną chorobę, jeśli korzyści przewyższają ryzyko — to tzw. przepisywanie poza wskazaniem. „Jedno na cztery recepty” w Stanach Zjednoczonych to właśnie taki proceder. Zaczyna badać swoją krew w laboratorium, szukając leku, który już istnieje i może uspokoić kosmiczny chaos jego układu immunologicznego. Odkrywa, że jeden „kanał komunikacyjny” w jego układzie odpornościowym jest nadmiernie aktywny. Znajduje, że stary lek transplantacyjny — używany od dekad — mógłby ten kanał wyciszyć. Ten lek nigdy nie był używany w chorobie Castlemana. Ale nie ma opcji. I wtedy wypowiada zdanie, które brzmi jak naukowa odwaga i surowa desperacja zarazem: „Zacząłem to testować na sobie.”

Sirolimus i remisja — życie po chorobie
W trzy latach przed zastosowaniem sirolimusu, David prawie umierał pięć razy. Po rozpoczęciu sirolimusu pozostaje w remisji przez ponad jedenaście lat. Jedenaście. Sala bije brawo. Ludzie wiwatują. Przez chwilę wydaje się, że to koniec opowieści. Jednak David nie traktuje tego jako osobistego cudu. Przekształca to w oskarżenie systemu. Podczas remisji ożenił się z Caitlin. Mają dwoje dzieci. Pisa książkę *Ścigając moje lekarstwo*, która — jak mówi — ma zostać zekranizowana. Zostaje profesorem na Uniwersytecie Pensylwiańskim. Zamiast mówić „Jestem uratowany,” zadaje pytanie: co z tymi, którzy nie mają szans — ani wiedzy, ani uporu — by zrobić to, co on zrobił? Co z tymi, którzy giną, kiedy rozwiązanie jest na wyciągnięcie ręki? Po ponad dekadzie remisji, David wciąż pyta: co by było, gdyby tak wielu miało dostęp do potencjalnych leków, które już istnieją?

System wśród leków — AI i walka o lepsze jutro
W 2022 roku David współzałożył organizację Every Cure. Jej misja jest brutalnie prosta: odblokować „pełny potencjał każdego leku” dla „każdej choroby”, którą może leczyć. Twierdzi, że już opracowali 14 ponownie zastosowanych terapii dla wielu chorób, ratując tysiące istnień. Nie ogranicza się do danych: wymienia ludzi. Kylo — dzięki ponownie zastosowanemu lekowi na raka szpiku — zaczęła pierwszy rok studiów pielęgniarskich; ta terapia jest obecnie badana w badaniach klinicznych. Michael — odprowadził swojego syna do ołtarza po tym, jak melanoma‑lek został ponownie zastosowany w leczeniu rzadkiego nowotworu Michaela. Ten sposób leczenia jest teraz używany na całym świecie w tym rzadkim nowotworze. Ale jego największe twierdzenie brzmi ostrze: ile istniejących leków leży na półkach aptek, nieużywanych, nie z powodu braku nauki, lecz braku zachęty? Liczy: 4 000 leków dla 4 000 chorób, a ponad 14 000 chorób bez zatwierdzonej terapii — to ogromny, niewykorzystany potencjał. Jedno na dziesięć z nas i naszych dzieci może rozwinąć rzadką chorobę bez zatwierdzonej terapii. Według niego główny powód to zysk: „Krótka odpowiedź: po prostu nie opłaca się realizować nowego zastosowania istniejącego leku, zwłaszcza dla rzadkiej choroby.” Dodatkowo, 80% leków, które są już generykami, nie przynosi wystarczających zwrotów z badań klinicznych. System — przewidywalnie — skupia się na nowych lekach dla chorób przynoszących zysk. Nikt — NIH, FDA, przemysł farmaceutyczny — nikt nie wziął odpowiedzialności za systemowe odblokowywanie tych ukrytych leków. „…aż do teraz,” dodaje, co oznacza, że Every Cure próbuje wypełnić tę lukę. Tutaj wprowadza broń: sztuczną inteligencję. Every Cure używa AI, by „skanować całkowitą wiedzę świata” o 4 000 leków i 18 000 chorób, by znaleźć najlepsze dopasowania. Porównuje to do Netflixa: podobnie jak Netflix przewiduje, co będziesz oglądać, ich AI ocenia, jak leki i choroby mogą ze sobą współgrać, i wskazuje, który zatwierdzony lek może zadziałać na chorobę, której nie było w planie. Nie chodzi o magiczną AI sztuczkę — to ogromny problem filtrowania. AI ocenia „miliony dopasowań lek–choroba,” filtruje je, a następnie pcha programy naprzód: do laboratoriów, badań klinicznych albo, gdy dowody już istnieją, do praktyki lekarskiej. Początkowo nie wiedzieli, jak to będzie realne, ani jak sfinansować to przedsięwzięcie. Potem dostał email z TED‑owej społeczności o The Audacious Project — inicjatywie, która wybiera około dziesięciu organizacji non‑profit rocznie, aby sfinansować odważne rozwiązania gigantycznych problemów. Sam fakt istnienia projektu dał im odwagę, by spróbować. Założyli organizację. Złożyli wniosek. Byli „tak bardzo nadziei,” że zostaną wybrani. Nie zostali. Sala śmieje się, bo opowiada to jak życiową chwilę, a nie porażkę PR. Zdecydowali ponownie. I „zaledwie kilka miesięcy temu” otrzymali „transformacyjne finansowanie.” Dodatkowe wsparcie przyszło od ARPA‑H. Dzięki temu twierdzą, że budują silnik AI, który ma ponownie zastosować „15–25 terapii do 2030 roku” — a z większym finansowaniem „dziesiątki, a nawet setki.” Potem wraca do Castleman — kolejna ofiara, ten sam przerażający wyrok. Terapie, które David odnalazł dla siebie, nie zadziałały na tego pacjenta. Pacjent miał pożegnać żonę i córkę, miał być przeniesiony do hospicjum. Every Cure poleciło „numer jeden lek,” i — „co zdumiewające” — uratowało mu życie. Pacjent jest w remisji od ponad dwóch lat. Czasem, mówi, nie chodzi o nowy dopasowanie: czasem dopasowanie już istnieje, ukryte w papierach, znane nielicznym specjalistom, nigdy nie wprowadzane szeroko. Opowiada o Leucoworynie — tanim związku pochodzenia witaminowego — który ma dowody sugerujące, że może poprawić mowę w podgrupie dzieci z przeciwciałami przeciwko receptorowi folianowemu i nie mogą transportować folianu do mózgu. Wskazuje na Richarda Frye’a, który przeprowadził pierwsze z trzech randomizowanych badań pokazujących korzyść w tej podgrupie. Następnie wymienia dziecko: Mason. Trzy lata. Niemy. I — jak mówi David — „W ciągu trzech dni od rozpoczęcia leucowowiryny, zaczął mówić swoje pierwsze słowa.” Owacje. Potem kolejne dziecko: Ryan. Pięć lat. „Praktycznie niemy.” Nigdy nie wyrażał pełnych myśli ani uczuć przed rodzicami. Lekarze powiedzieli, że „prawdopodobnie nigdy” nie będą w stanie okazać emocji. A następnie, „w ciągu dwóch tygodni” od leucowowiryny, Ryan zwraca się do ojca przed pracą i mówi: „Tatusiu, kocham cię.” Sala wybucha. David nie używa tego jako sentimentalnego kulminacyjnego momentu. Wykorzystuje to jako kolejne oskarżenie: istnieje test krwi, który może identyfikować dzieci takie jak Mason i Ryan — i ten test, jak mówi, wciąż jest rzadko stosowany. Dlatego stworzyli Every Cure: aby odblokować ukryte terapie i zapewnić, że dotrą one do każdego pacjenta, który mógłby z nich skorzystać. Dodaje jeszcze jedną historię z granicy medycyny: Joseph, umierający na POEMS. Na jego 30. urodziny powiedział „żegnaj” swojej dziewczynie Tarze. Jego lekarz już próbował wszystkiego, co przyszło mu do głowy. Every Cure poleciło trzy leki „często używane” w szpiczaku mnogim, bo POEMS jest podobny. „I niesamowicie — one zadziałały,” mówi David. Zamiast planować pogrzeb Józefa, Józef i Tara planują ślub. A Józef jest tam wśród widowni. Do tego momentu teza Davida stała się ludzką i brutalną: To nie o „optymalizacji badań.” To o ludziach, którzy żegnają się — i potem, jakoś, nie umierają. I o systemie, który na to pozwala, by stało się to przypadkiem, a nie standardową praktyką. Pod koniec otwiera oczy i zadaje pytanie, które wciąż powraca przy łóżkach szpitalnych: Ilu z nas było z kimś, kogo kochamy i słyszało: „Próbowaliśmy wszystkiego. Nie ma nic więcej, co możemy zrobić.” A potem pyta: „Co jeśli nie próbowaliśmy wszystkiego?” Co jeśli rozwiązanie istnieje dla nich — i dla tysięcy, może milionów z tą samą chorobą? Co jeśli lek już istnieje — i stoi na półce w aptece? W dyskusji po wystąpieniu prowadzący Latif Nasser mówi, że to brzmi „zbyt dobre, by było prawdziwe.” Ludzie umierają, czekając na odkrycie leczenia, ale może odpowiedź jest tak prosta — i tak odważna — jak pójście do apteki i znalezienie leku, który mógłby pomóc. David odpowiada: „Masz rację.” I powtarza powód, dla którego to nie dzieje się: „…poza tym to po prostu nie opłaca się.” Nasser wprowadza to w kontekst historyczny: medycyna kiedyś była „cure‑alls,” potem medycyna nowoczesna stała się oparta na dowodach, celowana, laserowo precyzyjna. Czy David mówi, że trzeba ponownie poszerzyć perspektywę? „Dokładnie,” odpowiada David. Dodaje coś, co brzmi jak ciche wyznanie o tym, jak działa przemysł: firmy często rozważają 15, 20, a nawet 30 chorób dla jednego leku, muszą wybrać jedną-dwie i skupić się, a inne możliwości „idą w zapomnienie.” Jego organizacja istnieje, aby wyciągać te zapomniane możliwości z pęknięć. A gdy pytano, co może zrobić zwykły człowiek, pozostaje praktyczny: jeśli kiedykolwiek skorzystałeś z leku „off‑label” lub ponownie zastosowanego, opowiedz o tym. Badania kosztują pieniądze. Świadomość i darowizny pomagają posuwać pracę naprzód. Ale najważniejsze zdanie w jego zakończeniu nie jest prośbą o darowizny. To moralny standard dla cywilizacji mającej 4 000 leków i 18 000 chorób: żaden pacjent nie powinien cierpieć, gdy lek ratujący życie „siedzi na półce w aptece.” I nikt nie powinien być zmuszony do akceptowania „próbowaliśmy wszystkiego” jako końca — gdy „wszystko” może nadal czekać, nieotwarte, tuż przed nami.


