Mehr als 100 Medikamente stören das Darmmikrobiom und erhöhen das Darmkrebsrisiko
Wissenschaftler haben mehr als 140 Medikamente entdeckt, die das Darmmikrobiom verändern, wodurch Bakterien um Nährstoffe konkurrieren – ein Zustand, der ein Ungleichgewicht im Darm verursacht und entzündliche Prozesse auslösen kann, die Krebs begünstigen. Stanford University Forscher konzentrierten sich auf gängige Medikamente, die das enorme Mikrobiom des Darms beeinflussen, mit potenziell weitreichenden Folgen für Stoffwechsel, Immunreaktion und Gesundheit insgesamt. Sie fanden heraus, dass potenziell tödliche Veränderungen im Darm resultieren, wenn bestimmte Medikamente Populationen von Bakterien abtöten und die Verfügbarkeit von Nährstoffen verändern.
In This Article:
- Darmmikrobiom unter Druck: Forscher decken 141 Medikamente auf
- Fallbeispiele aus dem Leben: Krebsdiagnosen unter jungen Erwachsenen
- Worte der Forscher: Ein neues Denken in der Pharmakologie
- Methodik der Studie: Wie das Experiment ablief
- Gesundheitspolitischer Kontext: Superbugs und Krebsrisiken
- Ausblick: Ökosystemdenken in der Medizin
Darmmikrobiom unter Druck: Forscher decken 141 Medikamente auf
Zu den Wirkstoffen gehörten 51 Antibiotika, bestimmte Chemotherapie-Medikamente, Antimykotika und Antipsychotika, die zur Behandlung von bipolaren Störungen und Schizophrenie eingesetzt werden. Die Medikamente schufen eine neue Umgebung im Darm, in der die am stärksten medikamentenresistenten Bakterien überlebten und schwächere Stämme abgetötet wurden. Wenn Medikamente schwächere Populationen der Darmbakterien abtöten, bleiben alle Zucker, Aminosäuren und andere Moleküle, auf die sie bisher angewiesen waren, im Darm zurück, damit die gefährlicheren Stämme davon gedeihen können. Dies ermöglicht es schädlichen, entzündlichen Arten zu explode, im Wachstum zu explodieren, was dauerhaft das Gleichgewicht des Darms verändert und einen Zustand schafft, der Krebs fördert. Die überlebenden Bakterien können das Mikrobiom des Körpers in einen pro‑inflammatorischen Zustand verwandeln und so das Risiko für kolorektalen Krebs erhöhen.

Fallbeispiele aus dem Leben: Krebsdiagnosen unter jungen Erwachsenen
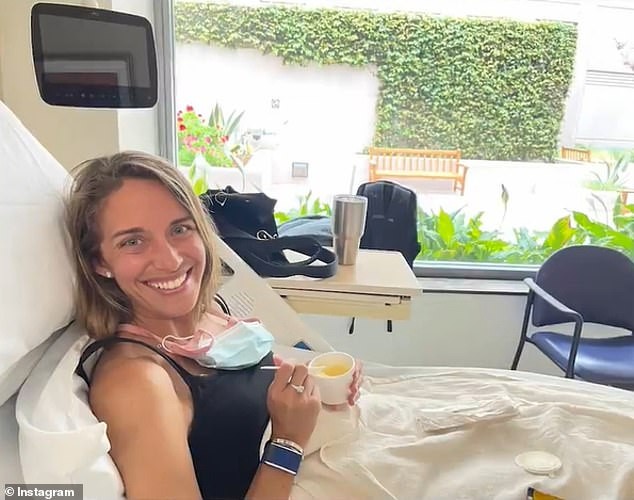
Marisa Peters, eine Mutter von drei Kindern aus Kalifornien (im Bild hier), war damals 39 Jahre alt und im Sommer 2021 wurde bei ihr ein Stadium‑3-Rektumkrebs diagnostiziert. Peters’ Krebs gilt als früh auftretender Krebs, der Fälle bei Menschen unter 50 betrifft, die in den USA zunehmen. Trey Mancini (im Bild hier) erhielt die Diagnose eines 'aggressiven' Stadium‑III‑Dickdarmkrebs im Alter von 28 Jahren. Er erzählte DailyMail.com, dass er, wenn er nicht routinemäßige Blutuntersuchungen für Baseball gehabt hätte, möglicherweise nicht diagnostiziert worden wäre, 'bis es zu spät gewesen wäre'.

Worte der Forscher: Ein neues Denken in der Pharmakologie
Lead researcher Dr Handuo Shi sagte in einer Erklärung: „In other words, drugs don’t just kill bacteria; they also reshuffle the 'buffet' in our gut, and that reshuffling shapes which bacteria win.” Dr KC Huang, Mikrobiologe und Immunologe an der Stanford University und leitender Forscher, fügte hinzu: „Understanding how microbes are competing for food ends up telling a really large part of this collateral damage story. It enables us to predict who is going to live, who is going to die, and makes the ensuing chaos seem really intuitive. I think that’s what we’re most excited about.” Shi sagte: „Our study pushes a shift from thinking of drugs as acting on a single microbe to thinking of them as acting on an ecosystem. If we can understand and model the ecosystem response, we could one day choose drugs and accompanying diets or probiotics not only based on how well they treat a disease, but also on how they preserve or promote a healthy microbiome.” „Wenn wir die Ökosystemreaktion verstehen und modellieren können, könnten wir eines Tages Medikamente und begleitende Diäten oder Probiotika nicht nur danach auswählen, wie gut sie eine Krankheit behandeln, sondern auch danach, wie sie ein gesundes Mikrobiom bewahren oder fördern.”

Methodik der Studie: Wie das Experiment ablief
Die Forscher nahmen eine menschliche Stuhlprobe, verwendeten sie, um eine Maus zu kolonisieren, und nutzten deren Darminhalte, um eine stabile mikrobielle Gemeinschaft zu erzeugen, die sie in einer Labordimühle kultivieren konnten. Die bakteriellen Gemeinschaften enthielten Dozen verschiedener Arten, die wie im menschlichen Darm miteinander interagierten. Anschließend setzten sie die Mäuse 707 verschiedene Medikamente aus, je ein Experiment, alle in der gleichen Konzentration. Nachdem sie über ein Dutzend Gemeinschaften von Bakterien mit den Medikamenten kultiviert hatten, testeten sie, wie viele dieser Gemeinschaften nach dem Kontakt mit den Medikamenten, den Nährstoffen und Abfällen von sterbenden Stämmen überlebten und maßen das Gesamtwachstum der Gemeinschaft, um zu sehen, wie stark jedes Medikament sie hemmte. Ein zentrales Beispiel betraf zwei nützliche Bakterienarten, die in einer Teströhre überlebten, wenn ihnen das eisenhaltige Molekül Häm zugeführt wurde. Im Darm erhalten sie ihr Häm nicht direkt und müssen auf andere Bakterien angewiesen sein, die es produzieren. Das Antimykotikum tötete jedoch die Bakterien, die normalerweise diese Verbindung liefern, wodurch die Nahrungsquelle unterbrochen wurde. Plötzlich verhungert und geschwächt, wurden die vorteilhaften Arten anfällig für ein Medikament, das sie zuvor widerstanden, und schädliche Stämme nutzten die übrig gebliebenen Nährstoffe und gedeihten. Der durch die 141 Medikamente verursachte Schaden, der ganze Gemeinschaften von Bakterien auslöschte, war oft dauerhaft, und Gemeinschaften kehrten nach dem Absetzen der Medikamente oft nicht zu ihrem ursprünglichen Zustand zurück. Die resultierende Dysbiose schafft einen Zustand chronischer Entzündung im Darm, der die DNA von Dickdarmzellen schädigen und Prozesse befeuern kann, die kolorektalen Krebs hervorrufen. Eine Dysbiose kann schädliche Abfallstoffe und Nebenprodukte erzeugen, darunter Colibactin, das von bestimmten E. coli-Bakterien produziert wird, und Krebs fördern. Colibactin schädigt die DNA der Dickdarmzellen, was Mutationen verursacht, die die Krebsentwicklung beeinflussen. In einem Schlüsselfall waren zwei Bacteroides-Arten resistent gegen ein Antimykotikum in einer Teströhre, wenn ihnen das eisenhaltige Molekül (Häm) zugeführt wurde. Im Darm waren sie jedoch auf die Produktion von Häme durch andere Bakterien angewiesen. Das Medikament unterbrach die Versorgung, wodurch sie verhungerten. Die Diagramme zeigten die Verteilung der verschiedenen Bakterienarten, während die Medikamentenkonzentration zunahm.

Gesundheitspolitischer Kontext: Superbugs und Krebsrisiken
Ärzte in den USA warnen seit Jahren vor einer zunehmenden Resistenz gegen gängige Antibiotika, die als 'Superbugs' bezeichnet werden. Die jüngste Untersuchung der American Cancer Society zeigte einen dramatischen Anstieg kolorektaler Krebsfälle bei Erwachsenen unter 55 Jahren, wobei Diagnosen bei 45- bis 49-Jährigen sich von einem jährlichen Anstieg von 1 Prozent vor 2019 zu einem jährlichen Anstieg von 12 Prozent bis 2022 beschleunigten. Eine separate Analyse kam zu dem Schluss, dass Dickdarmkrebs zu den am schnellsten wachsenden Krebsarten bei jungen Erwachsenen gehört, insbesondere bei 20- bis 29-Jährigen, wo die Fälle durchschnittlich um 2,4 Prozent pro Jahr zunehmen. Es wird erwartet, dass die Krankheit bis 2030 die häufigste Krebsform bei Menschen unter 50 wird.

Ausblick: Ökosystemdenken in der Medizin
Die Arbeit des Stanford-Teams bietet anderen Wissenschaftlern ein Werkzeug, um die Auswirkung eines Medikaments auf das Darmbakterien-Ökosystem vorherzusagen, und eröffnet Strategien, das Mikrobiom nach Behandlungen zu schützen oder rasch wiederherzustellen. Shi sagte: „Unsere Studie verschiebt den Denkansatz von der Vorstellung, dass Medikamente auf einen einzelnen Mikroben wirken, zu der Idee, dass sie auf ein Ökosystem wirken. Wenn wir die Ökosystemreaktion verstehen und modellieren können, könnten wir eines Tages Medikamente und begleitende Diäten oder Probiotika nicht nur danach auswählen, wie gut sie eine Krankheit behandeln, sondern auch danach, wie sie ein gesundes Mikrobiom bewahren oder fördern.“ „If we can understand and model the ecosystem response, we could one day choose drugs and accompanying diets or probiotics not only based on how well they treat a disease, but also on how they preserve or promote a healthy microbiome.” Die Ergebnisse wurden in der Fachzeitschrift Cell veröffentlicht.


